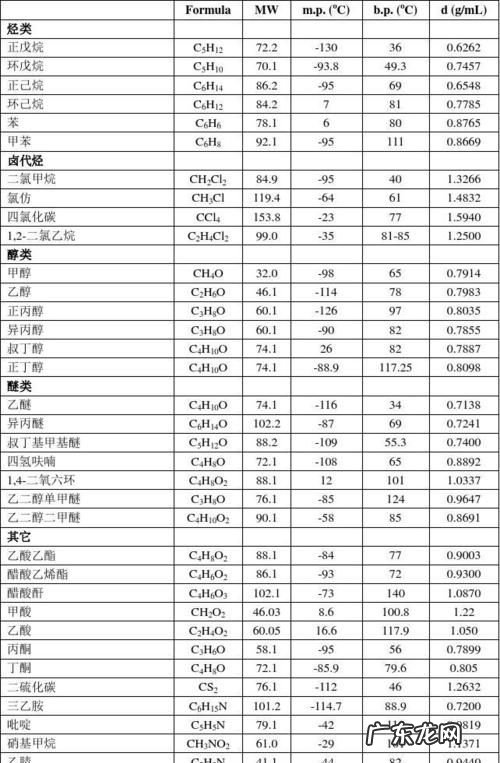
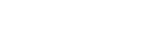什么是物质的熔点和凝固点物质的熔点(melting point),即在一定压力下,纯物质的固态和液态呈平衡时的温度,也就是说在该压力和熔点温度下,纯物质呈固态的化学势和呈液态的化学势相等,而对于分散度极大的纯物质固态体系(纳米体系)来说,表面部分不能忽视 , 其化学势则不仅是温度和压力的函数,而且还与固体颗粒的粒径有关.
原理
熔点是固体将其物态由固态转变(熔化)为液态的温度 。进行相反动作(即由液态转为固态)的温度,称之为凝固点 。与沸点不同的是,熔点受压力的影响很小 。而大多数情况下一个物体的熔点就等于凝固点 。
晶体开始融化时的温度叫做熔点 。物质有晶体和非晶体,晶体有熔点,而非晶体则没有熔点 。晶体又因类型不同而熔点也不同.一般来说晶体熔点从高到低为,原子晶体>离子晶体>金属晶体>分子晶体 。在分子晶体中又有比较特殊的,如水,氨气等.它们的分子只间因为含有氢键而不符合"同主组元素的氢化物熔点规律性变化''的规律 。熔点是一种物质的一个物理性质 。物质的熔点并不是固定不变的,有两个因素对熔点影响很大 。一是压强,平时所说的物质的熔点,通常是指一个大气压时的情况;如果压强变化,熔点也要发生变化 。熔点随压强的变化有两种不同的情况.对于大多数物质,熔化过程是体积变大的过程,当压强增大时 , 这些物质的熔点要升高;对于像水这样的物质,与大多数物质不同,冰熔化成水的过程体积要缩小(金属铋、锑等也是如此) , 当压强增大时冰的熔点要降低 。另一个就是物质中的杂质,我们平时所说的物质的熔点,通常是指纯净的物质 。但在现实生活中,大部分的物质都是含有其它的物质的,比如在纯净的液态物质中熔有少量其他物质,或称为杂质,即使数量很少,物质的熔点也会有很大的变化,例如水中熔有盐,熔点就会明显下降,海水就是熔有盐的水 , 海水冬天结冰的温度比河水低,就是这个原因 。饱和食盐水的熔点可下降到约-22℃,北方的城市在冬天下大雪时 , 常常往公路的积雪上撒盐 , 只要这时的温度高于-22℃ , 足够的盐总可以使冰雪熔化,这也是一个利用熔点在日常生活中的应用 。熔点实质上是该物质固、液两相可以共存并处于平衡的温度,以冰熔化成水为例,在一个大气压下冰的熔点是0℃,而温度为0℃时,冰和水可以共存,如果与外界没有热交换,冰和水共存的状态可以长期保持稳定 。在各种晶体中粒子之间相互作用力不同,因而熔点各不相同 。同一种晶体,熔点与压强有关,一般取在1大气压下物质的熔点为正常熔点 。在一定压强下,晶体物质的熔点和凝固点都相同 。熔解时体积膨胀的物质,在压强增加时熔点就要升高 。在有机化学领域中,对于纯粹的有机化合物,一般都有固定熔点 。即在一定压力下,固-液两相之间的变化都是非常敏锐的,初熔至全熔的温度不超过0.5~1℃(熔点范围或称熔距、熔程) 。但如混有杂质则其熔点下降,且熔距也较长 。因此熔点测定是辨认物质本性的基本手段,也是纯度测定的重要方法之一 。测定方法一般用毛细管法和微量熔点测定法。在实际应用中我们都是利用专业的测熔点仪来对一种物质进行测定 。(右图就是一台显微图像熔点仪) 钨(W)是熔点最高的金属,在2000℃-2500℃高温下,蒸汽压仍很低 。钨的硬度大 , 密度高 , 高温强度好 。

文章插图
熔点测定及温度计的校正实验报告纯物质的熔点和不纯物质的熔点有什么区别熔点的测定 熔点是有机化合物最重要的物理常数之一,常以m.p.表示 。它不仅可以用来鉴定固体有机物,同时根据熔程(自初熔至全熔的温度范围)的长短可定性地判别该物质的纯度 。此外 , 根据混合熔点是否下降,还可以判断熔点相同的化合物是否是同一种物质 。1.基本原理 物质的熔点是指该物质的固液两态在大气压力下达到平衡时的温度 。纯的固体有机化合物一般都具有固定的熔点,即在大气压力下,固液两态之间的变化非常敏锐,熔程不超过0.5~1℃,但如混有杂质时 , 则其熔点下降,且熔程也较长 。纯物质的熔点可以从蒸气压与温度的变化曲线(图1)来理解 。固态蒸气压—温度曲线SM的变化速率比相应的液态蒸气压—温度曲线 ML的变化速率大,因而两曲线相交在M点,这时的温度TM即为该物质的熔点 。只有在此温度时,固液两相的蒸气压才相等,固液两相才达到平衡,这就是纯晶体物质有固定熔点的原因 。当温度消超过TM , 即使很小的变化时,只要有足够的时间,固体就可以全部转变为液体 。因此,为了精确测定熔点,在接近熔点时加热速度一定要缓慢 , 这样才能使熔化过程尽可能接近于两相平衡的条件 。若化合物含有杂质,并假定两者不生成固溶体,则根据拉乌尔定律,在一定压力和温度下 , 在溶剂中增加溶质的量 , 将导致溶剂蒸气分压的降低 , 所以出现新的液态曲线M1L1,在M1点建立新的平衡,相应的温度为 TM1,即发生熔点下降 。应当指出 , 如有杂质存在,融化过程中固相和液相平衡时的相对量在不断改变,因此两相平衡时不是一个温度点TM1,而是从最低共熔点(与杂质能共同结晶成共熔混合物,其熔化的温度称之为最低共熔点)到TM1一段 。这说明杂质的存在不但使初熔温度降低,而且还会使熔程变长 , 所以在测熔点时一定要记录初熔和全熔
文章插图
物质的纯度与熔点有什么关系不同的晶体熔点不同,同种物质的熔点与凝固点相同 。同一种晶体的熔点与气压和纯度有关 。某物质混入杂质后,其熔点会有所变化 , 所以,测定的熔点越接近该物质的理论值此物质纯度越高,这就是用测熔点的方法判断纯度的原理 。

文章插图
高中化学物质熔沸点比较规律物质熔、沸点高低的规律小结
熔点是固体将其物态由固态转变(熔化)为液态的温度 。熔点是一种物质的一个物理性质 , 物质的熔点并不是固定不变的,有两个因素对熔点影响很大,一是压强 , 平时所说的物质的熔点,通常是指一个大气压时的情况,如果压强变化,熔点也要发生变化;另一个就是物质中的杂质,我们平时所说的物质的熔点 , 通常是指纯净的物质 。沸点指液体饱和蒸气压与外界压强相同时的温度 。外压力为标准压(1.01×105Pa)时,称正常沸点 。外界压强越低,沸点也越低,因此减压可降低沸点 。沸点时呈气、液平衡状态 。
在近年的高考试题及高考模拟题中我们常遇到这样的题目:
下列物质按熔沸点由低到高的顺序排列的是 ,
A、二氧化硅,氢氧化钠,萘
B、钠、钾、铯
C、干冰,氧化镁,
磷酸
D、C2H6,C(CH3)4,CH3(CH2)3CH3
在我们现行的教科书中并没有完整总结物质的熔沸点的文字 , 在中学阶段的解题过程中,具体比较物质的熔点、沸点的规律主要有如下:
根据物质在相同条件下的状态不同
一般熔、沸点:固>液>气,如:碘单质>汞>CO2
2.
由周期表看主族单质的熔、沸点
同一主族单质的熔点基本上是越向下金属熔点渐低;而非金属单质熔点、沸点渐高 。但碳族元素特殊 , 即C,Si,Ge,Sn越向下,熔点越低,与金属族相似;还有ⅢA族的镓熔点比铟、铊低;ⅣA族的锡熔点比铅低 。
3.
同周期中的几个区域的熔点规律
①
高熔点单质
C,Si,B三角形小区域,因其为原子晶体,故熔点高,金刚石和石墨的熔点最高大于3550℃ 。金属元素的高熔点区在过渡元素的中部和中下部,其最高熔点为钨(3410℃) 。
②
低熔点单质
非金属低熔点单质集中于周期表的右和右上方,另有IA的氢气 。其中稀有气体熔、沸点均为同周期的最低者,如氦的熔点(-272.2℃,26×105Pa)、沸点(268.9℃)最低 。
金属的低熔点区有两处:IA、ⅡB族Zn,Cd,Hg及ⅢA族中Al,Ge,Th;ⅣA族的Sn,Pb;ⅤA族的Sb,Bi,呈三角形分布 。最低熔点是Hg(-38.87℃) , 近常温呈液态的镓(29.78℃)铯(28.4℃),体温即能使其熔化 。
4.
从晶体类型看熔、沸点规律
晶体纯物质有固定熔点;不纯物质凝固点与成分有关(凝固点不固定) 。
非晶体物质,如玻璃、水泥、石蜡、塑料等,受热变软,渐变流动性(软化过程)直至液体,没有熔点 。
①
原子晶体的熔、沸点高于离子晶体,又高于分子晶体 。
在原子晶体中成键元素之间共价键越短的键能越大,则熔点越高 。判断时可由原子半径推导出键长、键能再比较 。如
键长:
金刚石(C—C)>碳化硅(Si—C)>晶体硅
(Si—Si) 。
熔点:金刚石>碳化硅>晶体硅
②在离子晶体中,化学式与结构相似时,阴阳离子半径之和越?。?离子键越强 , 熔沸点越高 。反之越低 。
如KF>KCl>KBr>KI,CaO>KCl 。
③
分子晶体的熔沸点由分子间作用力而定,分子晶体分子间作用力越大物质的熔沸点越高 , 反之越低 。(具有氢键的分子晶体 , 熔沸点
反常地高,如:H2O>H2Te>H2Se>H2S,C2H5OH>CH3—O—CH3) 。对于分子晶体而言又与极性大小有关,其判断思路大体是:
ⅰ
组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,物质的熔沸点越高 。如:CH4<SiH4<GeH4<SnH4 。
ⅱ
组成和结构不相似的物质(相对分子质量相近),分子极性越大,其熔沸点就越高 。如:
CO>N2,CH3OH>CH3—CH3 。
ⅲ
在高级脂肪酸形成的油脂中,不饱和程度越大,熔沸点越低 。如:
C17H35COOH(硬脂酸)>C17H33COOH(油酸);
ⅳ
烃、卤代烃、醇、醛、羧酸等有机物一般随着分子里碳原子数增加,熔沸点升高,如C2H6>CH4,
C2H5Cl>CH3Cl,CH3COOH>HCOOH 。
ⅴ
同分异构体:链烃及其衍生物的同分异构体随着支链增多 , 熔沸点降低 。如:CH3(CH2)3CH3
(正)>CH3CH2CH(CH3)2(异)>(CH3)4C(新) 。芳香烃的异构体有两个取代基时,熔点按对、邻、
间位降低 。(沸点按邻、间、对位降低)
④
金属晶体:金属单质和合金属于金属晶体,其中熔、沸点高的比例数很大,如钨、铂等(但也有低的如汞、铯等) 。在金属晶体中金属原子的价电子数越多,原子半径越小,金属阳离子与自由电子静电作用越强,金属键越强,熔沸点越高,反之越低 。如:Na<Mg<Al 。
合金的熔沸点一般说比它各组份纯金属的熔沸点低 。如铝硅合金<纯铝(或纯硅) 。
5.
某些物质熔沸点高、低的规律性
①
同周期主族(短周期)金属熔点 。如
Li
文章插图
【纯物质的熔点和不纯物质的熔点有什么区别,什么是物质的熔点和凝固点】
- 炒锅什么材质的用起来比较健康,什么材质的炒锅最好用又健康安全
- 合金是什么材质褪色,铜合金材质的戒指会掉色
- 水杯什么材质的健康,哪种材质的水杯安全又健康
- 怎么判断鲍鱼死了多久,怎么判断鲍鱼是不是变质 判断鲍鱼变质的方法
- 麦石锅是什么材质的,麦石锅是什么材质的
- 微波炉用什么材质的碗比较安全,微波炉要用什么材质的碗加热
- 微波炉上面可以放东西,微波炉里不能放什么材质的东西
- 含蛋白质的蔬菜水果有什么,什么水果蔬菜等含蛋白质最高
- 米黄玉是黄龙玉吗?,这个是什么材质的是玉石不有无收藏价值
- 甲醛是voc物质的一种,voc包括甲醛和苯
特别声明:本站内容均来自网友提供或互联网,仅供参考,请勿用于商业和其他非法用途。如果侵犯了您的权益请与我们联系,我们将在24小时内删除。